Ley de Dalton: Las proporciones múltiples y las presiones variables
La ley de Dalton escrita en 1802 es la ley más básica escrita por el físico, químico, y matemático británico John Dalton. Calcula la presión total de las presiones parciales de una mezcla de gases, y las proporciones múltiples de un elemento. Dando paso, a distintos argumentos sobre su validez y permitiendo así la interpretación de las leyes ponderales de las combinaciones químicas y la comprensión de las transformaciones de una sustancia en otras. Con pequeñas modificaciones sirvió de guía durante todo el siglo XIX para el desarrollo de la química.
Qué dice la ley de Dalton
Dalton establece que, a una temperatura estable, la presión total de una mezcla de gases que no reaccionan químicamente entre sí, es igual a la suma de las presiones parciales que ejercería cada uno de sus componentes. Como si fuese uno solo el que ocupa todo el volumen de la mezcla. Dado que la presión de una mezcla de gases ideales, solo depende del número de moléculas de gas en el recipiente. La ley de Dalton es muy útil cuando deseamos determinar la presión total de una mezcla.
Se basa en la combinación de un elemento con la cantidad de otro elemento para así, formar un compuesto distinto, siempre y cuando, tengan una relación de números enteros. Cuando combinamos dos elementos, podemos dar lugar a dos o más compuestos químicos, las cantidades de uno de ellos, y la cantidad fija del otro guardando de esta manera, una relación de números enteros sencillos. De esta manera Dalton trató de unificar los símbolos, de tal forma que con una sola representación se entendiera de qué elemento se trataba.
Ley de las proporciones múltiples
Esta ley surge en 1803. Explica que las cantidades de un mismo elemento, que se unen con una cantidad fija de otro elemento, forman un compuesto distinto en cada caso, estando en una relación de números enteros sencillos. Dalton observó y estudió un fenómeno del cual Proust no se había percatado, en el que algunos elementos entre sí en distintas proporciones originan compuestos distintos. Hoy se conoce como los diferentes estados de oxidación de un elemento, que permite combinarse en diferentes proporciones con otro elemento.
Dalton descubrió, que una molécula de agua siempre contiene la misma proporción de oxígeno e hidrógeno. Pensó que los átomos de oxígeno eran más pesados que los de hidrógeno y así es, el de oxígeno pesa 16 veces más que el de hidrógeno. Así La ley de proporciones múltiples, se convirtió en prueba clave para la teoría atómica de Dalton, aunque hoy en día, existen dudas de si fue con base en esta ley o lo descubrió por accidente.
Ejemplo de la ley de las proporciones múltiples
Conviene recordar que, cuando esta ley fue formulada ciertas comprobaciones no podían llevarse a cabo, por ser de carácter empírico. Así tomamos el cobre y el oxígeno, combinamos para formar dos óxidos de cobre distintos, el CuO y el Cu2O. En el primer compuesto, encontramos, 3,973 gramos de cobre y se combinan con un gramo de oxígeno. En el segundo compuesto 7,945 gramos de cobre, se une a cada gramo de oxígeno. Buscamos la relación en 7,945/3,973 y obtenemos un número entero sencillo, el 2 tal como predijo Dalton.
También se puede combinar el nitrógeno y el oxígeno formando así tres compuestos:
- Óxido nitroso N2O. Se combinan 28 gramos de nitrógeno con 16 gramos de oxígeno siendo N2O 28/1 x 16 = 7/4.
- Óxido de nitrógeno N2O2. Se combinan 28 gramos de nitrógeno con 32 gramos de oxígeno, siendo N2O2 28/2 x 16 = 7/8.
- Y anhídrido nitroso N2O3. Se combinan 28 gramos de nitrógeno con 48 gramos de oxígeno, siendo N2O3 28/3 x 16 = 7/12.
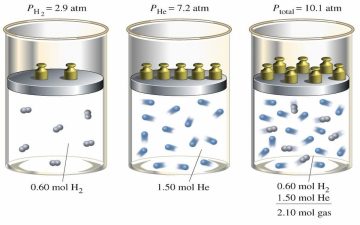
Ley de presiones parciales
Ley que permite explicar el comportamiento ideal de una mezcla de gases. Enunciada en 1801 por el británico Dalton, la cual indica que, la presión de una mezcla de gases ideales entre sí, se da cuando sumamos las presiones parciales de cada uno de los componentes. Esta ley trae consigo dos fórmulas distintas, una que es la suma de las presiones parciales y donde muestra que PTotal = Pgas 1 + Pgas 2 + Pgas 3. Lo que es lo mismo según la ecuación de mezcla de gases perfectos.
La presión de cada gas, es la presión del gas que ejercería si fuera el único gas en un recipiente. Esto se debe a que suponemos que no hay fuerza de atracción entre los gases y cada uno de ellos ejerce una presión parcial igual. Mientras que, en términos de fracción molar, un gas es el número de moles de ese gas entre el número total de moles en la mezcla. Normalmente, se abrevia con x =fracción molar de gas 1
Ejemplo de la ley de presiones parciales
De 64 gramos de oxígeno y 49 g de nitrógeno se obtiene una mezcla que ocupa 10,1 de volumen, a 27 °C. Calculamos el número de moles de O2 y de N2 existentes en la mezcla. Moles de O2: n1 = 64/32 = 2. Moles de N2: n2 = 49/28 = 1,75 aplicando PV = nRT, por separado de los dos gases: P1 x 10=2 x 0,082 x (203+27). P1 = Pp de O2 = 4,92 atm y P2 x 10 = 1,75 x 0,082x (273+27) P2 = Pp de N2 con 4,305 atm.
Tenemos una mezcla de gas de hidrógeno H2 y gas de oxígeno O2 y la mezcla contiene 6,7 moles de gas de hidrógeno y 3,3 moles de gas de oxígeno. La mezcla está en un recipiente de 3001 a 273K, y la presión de la mezcla de gases es de 0,75 atm: PH2 V=nH2 RT despejamos y tenemos PH2 = nH2RT/V siendo así igual a (6,7 mol) (0,08206 atm x 1/mol x K). (273K) dividido todo entre 3001 igual a 0,50 atm.
Cómo se aplica la ley de Dalton
La ley de Dalton se aplica, cuando hablamos de la presión atmosférica, o cuando mencionamos los distintos componentes químicos que son existentes en nuestro planeta. Y nos permite crear modelos atómicos experimentales, relacionados con las leyes de la combinación química. La presión parcial del oxígeno y del nitrógeno a presión atmosférica. Es decir, 1 ATA será PpO2 = 21/100×1 = 0,21 atmósferas y PpN2 = 79/100×1= 0,79 atmósferas. La suma de las presiones parciales es igual a la presión absoluta de 0,21+0,79=1 atmósfera.
También podemos calcular que, a 10 metros de profundidad, donde la presión absoluta es de 2ATA, calculamos la presión parcial de cada componente del aire: PpO2 = 21/100 x 2 es igual a 0,42 atmósferas y PpN2= 79/100 x 2= 1,58 atmósferas. Entonces sí, sumamos sería PpO2 + PpN2 = 2ATA. Esta ley se sigue aplicando para innumerables estudios como, la combinación química de átomos, donde también encontramos desde el modelo atómico de Dalton, hasta cómo funciona la mezcla de ciertos gases.






